Dioxine
Definition
"Dioxine" ist ein Sammelbegriff für polychlorierte Dibenzodioxine und Dibenzofurane:
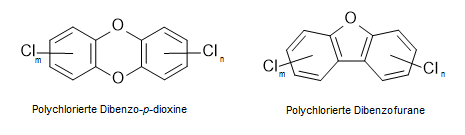
"Dioxine" im Sinne von Derivaten des Dioxins ist zwar für Dibenzofurane nicht mehr korrekt, jedoch hat sich der Begriff für beide Substanzklassen eingebürgert, weil sie häufig gemeinsam vorkommen und ähnlich schädlich wirken. "Dioxin" ist eigentlich eine falsche Bezeichnung, denn dieser Begriff bezeichnet lediglich den zentralen Ring, von dem übrigens kein toxisches Potential bekannt ist. Und wenn das Lösemittel "Dioxan" nur wegen der sprachlichen Ähnlichkeit in die Mithaftung für das toxische Potential übernommen wird, so zeugt das von chemischem Unverständnis.
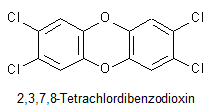
Die bekannteste und gleichzeitig auch die gefärlichste Verbindung ist das 2,3,7,8-Tetrachlordibenzodioxin (TCDD):
Seweso
In Seveso wurde in der Fabrik Icmesa aus 2,4,5-Trichlorphenol das Desinfektionsmittel Hexachlorophen hergestellt. Das 2,4,5-Trichlorphenol wird dazu in schwefelsaurem Medium mit Formaldehyd umgesetzt, welcher zwei Mal gemäß einer elektrophilen aromatischen Substitution reagiert:
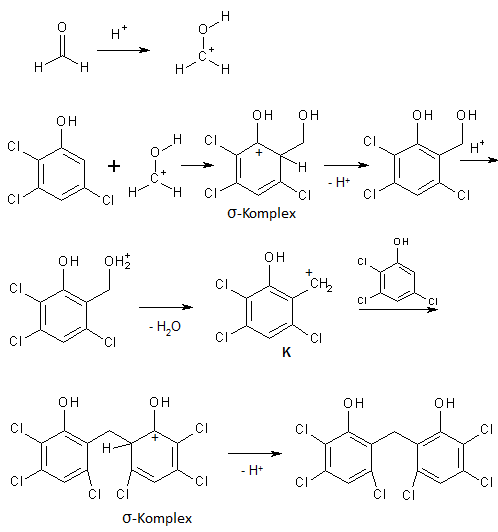
Für die σ-Komplexe können 6 Grenzformeln formuliert werden, weil alle vorhandenen Substituenten mesomer aktiv sind. Die Grenzformeln sind im Schema nicht eingezeichnet. Auch das Kation K, welches den Angriff auf ein zweites Molekül 2,4,5-Trichlorphenol einleitet, ist mesomeriestabilisiert, weshalb es sich leicht bildet.
Auch das für die Reaktion benötigte 2,4,5-Trichlorphenol wurde bei Icmesa aus 1,2,4,5-Tetrachlorbenzol durch Umsetzung mit Natriumhydroxid selbst hergestellt. Im Gegensatz zur voranstehend beschriebenen Synthese ist dies eine nucleophile aromatische Substitution, die aber ebenfalls über einen σ-Komplex läuft:
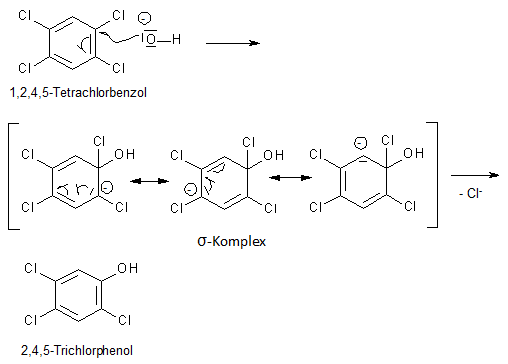
Die vorhandenen Chloratome erniedrigen im aromatischen Ring die Elektronendichte infolge ihres -I-Effekts. Besonders effektiv wirkt sich das bei den Chloratomen 2 und 4 aus, da diese direkt auf die im σ-Komplexe verteilte Ladung wirken können (siehe Abbildung). Chlorid ist überdies - analog zur Substitution am gesättigten C-Atom - auch hier eine recht gute Abgangsgruppe. Die Reaktion läuft unter den gegebenen Reaktionsbedingungen nur ein einziges Mal ab, weil die neu eintretende Hydroxyfunktion die Elektronendichte im Ring durch +M-Effekt erhöht und deshalb weitere nucleophile Substitutionen unmöglich macht. Dieser Effekt wird noch dadurch verstärkt, dass die Hydroxyfunktion durch den Mesomerieeffekt schwach sauer ist und im basischen Reaktionsmedium deshalb deprotoniert:
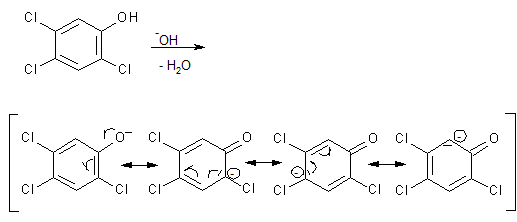
Im Jahr 1976 kam es in der Firma Icmesa infolge von Fahrlässigkeiten zu einer Überhitzung des Druckkessels, in dem die Herstellung des 2,4,5-Trichlorphenols durchgeführt wurde.
Aufgrund der Mesomeriestabilisierung ist das Phenolation weniger stark basisch als das Hydroxid und damit auch weniger nucleophil und reagiert deshalb bei guter Reaktionskontrolle kaum. Aufgrund der höheren Reaktionstemperatur vermochte es nun aber ebenfalls zu reagieren. Die Substanz reagierte dabei in zweimaliger nucleophiler aromatischer Substitution mit sich selbst und lieferte dabei das TCDD:
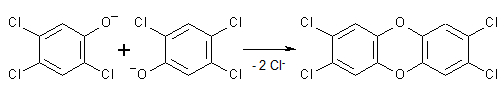
Infolge des zu hohen Drucks blies der Kessel die Reaktionsmischung über ein Sicherheitsventil ab. Man schätzt, dass etwa 1 bis 3 kg TCDD freigesetzt wurden. Auch der weitere Unfallverlauf ist ein Musterbeispiel von Fahrlässigkeit, Dummheit, Vertuschungsversuchen und krimineller Energie. Niemand wurde benachrichtigt, aufmerksam wurde man erst, nachdem 3000 Tierkadaver in der Umgebung aufgefunden wurden und 200 Personen mit schwerer Chlorakne vor ratlosen Ärzten standen. Auch Dekontaminationsarbeiten und Entsorgung der verseuchten Materialien sind eine Gruselgeschichte. Das "Sevesounglück" war der größte Chemieunfall auf europäischem Boden und ist zum Menetekel für Gefahren durch "die Chemie" geworden. ("Seveso ist überall")
Toxikologie
Die für den Menschen akut tödliche Dosis ist bisher nicht bekannt. Tierversuche helfen hier wenig, denn die Substanz wirkt auf unterschiedliche Organismen extrem unterschiedlich toxisch. Beobachtet wurden beim Menschen aber bereits schwere allgemeine Vergiftungserscheinungen wie Schwindel, Reizerscheinungen, Erbrechen, Nerven- und Leberschädigungen. Nach ein paar Tagen tritt eine Chlorakne auf. TCDD ist ein Krebspromotor. Das bedeutet, dass die Substanz die Immunabwehr daran hindert, neu gebildete Krebszellen zu erkennen und zu eliminieren. Ob Sie auch selbst Krebs auslösen kann, ist noch ungeklärt. Einerlei, beides kann dazu führen, dass ein Mensch an Krebs erkrankt. Deshalb wird die Substanz gefahrstoffrechtlich als krebserzeugend eingestuft. Die anderen Dioxine (s.o.) wirken grundsätzlich ähnlich, jedoch nicht so stark wie das TCDD. Deshalb wurde für die toxikologische Belastung der Begriff "Toxizitätsequivalente eingeführt. TCDD bekommt dabei den Wert 1, die anderen Dixione entsprechend ihrer Toxizität Werte <1.
Dioxine sind lipophil und reichern sich dadurch im Fettgewebe und damit auch in der Nahrungskette an. Umweltsünden können sich deshalb potenzieren. Forellen reichern z.B. in ihrem Körper Dioxine gegenüber dem Teichwasser im Verhältnis bis zu 1:4000 an. Bekannt geworden ist der "Eierskandal" aus dem Jahr 2010, bei dem belasteter Mais zu Tierfutter verarbeitet wurde. Der zulässige Grenzwert für die Dioxinbelastung liegt bei Eiern bei 3 pg TEQ Dioxinen/g Fett. Aus Fettdepots lassen sich Dioxine schwer wieder mobilisieren. Die Biologische Halbwertzeit für TCDD kan beim Menschen bis zu 10 Jahren betragen. Diese hohe Akkumulationsgefahr bedingt, dass Grenzwerte für Dioxinbelastungen extrem niedrig angesetzt werden müssen.
Vorkommen
Dass man wie beim Seweso-Unglück die Entstehung von Dioxinen mechanistisch aus konkreten Edukten ableiten kann, gehört zu den Ausnahmen. Weit verbreiteter ist die Bildung von Dioxinen bei der Verbrennung in Gegenwart von Halogenverbindungen. Das kann auch Kochsalz sein. Ein genauer Weg, wie sich in diesen Fällen Dioxine bilden können, ist nicht bekannt. Es ist eben so, dass viele Reaktionen nicht einheitlich verlaufen, sondern von Nebenreaktionen begleitet sind. Bei der Verbrennung organischer Substanzen oder Gemischen in Gegenwart von Halogenverbindungen entstehen nicht nur Dioxine als Nebenprodukt sondern z.B. auch Polycyclische Aromatische Kohlenwasserstoffe (PAKs).
Bei einer einzigen Beilstein-Probe kann bereits eine Menge an Dioxinen entstehen, die der maximal tolerierbaren täglichen Dosis entspricht. (Der Versuch muss deshalb im Abzug durchgeührt werden.) Lange Zeit war die Nachbarschaft von Müllverbrennungsanlagen wegen (angeblich) möglicher Dioxinfreisetzung gefürchtet. Heutzutage haben Müllverbrennungsanlagen das Dioxinproblem aber gut im Griff und die Gefahr droht eher vom Nachbarn, wenn der z.B. behandelte Hölzer illegal verbrennt. Selbst verbrannter Abfall erzeugt eine 10000-fache höhere Menge an Dioxinen als die Verbrennung in einer professionellen Müllverbrennungsanlage und ist heutzutage die mengenmäßig größte Dioxinfreisetzung. Auch bei Gebäudebränden kann eine so hohe Menge an Dioxinen freigesetzt werden, dass eine spezielle Dekontaminierung notwendig wird. (Halogenlieferant ist hier z.B. das PVC, aus dem z.B. Abwasserrohre gemacht werden.) Die optimale Temperatur für die Bildung von Dioxinen beträgt 300 - 600 °C. ("Dioxinfenster")
Weiterführende Links
- GESTIS (2,3,7,8-Tetrachlordibenzodioxin)
- Wikipedia (2,3,7,8-Tetrachlordibenzodioxin)
- Wikipedia (Polychlorierte Dibenzodioxine und Dibenzofurane)
- Wikipedia (Seveso-Unglück)
- Bundesinstitut für Risikobewertung
- Umweltbundesamt (Dioxine)
